
Revista Portuguesa de Estomatologia, Medicina Dentária e Cirurgia Maxilofacial
Revista Portuguesa de Estomatologia Medicina Dentária e Cirurgia Maxilofacial | 2020 | 61 (3) | 128-134
Investigação Original
Manifestações bucais da leucemia linfoblástica: estudo clínico em centro de referência hematológico no Amazonas
Buccal manifestations of lymphoblastic leukemia: a clinical study in a hematological reference center in the Amazon
a Programa de Pós-Graduação em Ciências Aplicadas à Hematologia. Universidade do Estado do Amazonas (UEA). Manaus, AM, Brasil
b Programa de Pós-Graduação em Odontologia (PPGO). Universidade Federal do Amazonas (UFAM), Manaus, AM, Brasil
c Fundação Hospitalar de Hematologia e Hemoterapia do Amazonas (HEMOAM). Manaus, AM, Brasil
d Departamento de Patologia e Medicina Legal (DPML). Universidade Federal do Amazonas (UFAM). Manaus, AM, Brasil
Tatiana Nayara Libório-Kimura - tliborio@ufam.edu.brtliborio@ufam.edu.brtliborio@ufam.edu.br
Article Info
Rev Port Estomatol Med Dent Cir Maxilofac
Volume - 61
Issue - 3
Investigação Original
Pages - 128-134
Go to Volume
Article History
Received on 30/01/2020
Accepted on 24/10/2020
Available Online on 16/11/2020
Keywords
Investiga��o Original
�
Manifesta��es bucais da leucemia linfobl�stica: estudo cl�nico em centro de refer�ncia hematol�gico no Amazonas
Buccal manifestations of lymphoblastic leukemia: a clinical study in a hematological reference center in the Amazon
�
Melina Cuenca de Mello e Piasa, Gerson de Oliveira Paiva Netob, C�lia Maria Bolognese Ferreirac, Tatiana Nayara Lib�rio-Kimuraa,b,d,*
a Programa de P�s-Gradua��o em Ci�ncias Aplicadas � Hematologia. Universidade do Estado do Amazonas (UEA). Manaus, AM, Brasil.
b Programa de P�s-Gradua��o em Odontologia (PPGO). Universidade Federal do Amazonas (UFAM), Manaus, AM, Brasil.
c Funda��o Hospitalar de Hematologia e Hemoterapia do Amazonas (HEMOAM). Manaus, AM, Brasil.
d Departamento de Patologia e Medicina Legal (DPML). Universidade Federal do Amazonas (UFAM). Manaus, AM, Brasil.
�
�
http://doi.org/10.24873/j.rpemd.2020.11.716
�
Resumo
Objetivos: Avaliar clinicamente a mucosa bucal de pacientes infantojuvenis com leucemia linfobl�stica.
M�todos: Num per�odo de doze meses, 36 pacientes com leucemia linfobl�stica de c�lulas B ou T, entre 1 e 14 anos, tratados pelos protocolos GBTLI-LLA 2009 ou ALL IC-BFM 2009 foram consecutivamente localizados. A mucosa bucal foi clinicamente avaliada no in�cio da pr�-fase/indu��o da quimioterapia e ao d�cimo quinto dia de tratamento.
Resultados: Dos 25 pacientes que tiveram a mucosa bucal avaliada, 64% (n=16) eram do sexo masculino com m�dia de idade de 6,9 anos e a maioria com leucemia linfobl�stica de c�lulas B (96%; n=24). Desses, 44% (n=11) apresentaram manifesta��es bucais, sendo a maioria no in�cio da pr�-fase/indu��o da quimioterapia. As manifesta��es encontradas foram pet�quias na mucosa bucal (31,6%; n=6), ressecamento labial (26,3%, n=5) e mucosite bucal (15,8%, n=3), sendo a mucosa n�o-queratinizada o s�tio de predile��o (84,2%, n=16).
Conclus�es: A frequ�ncia de manifesta��es bucais em pacientes infantojuvenis com leucemia linfobl�stica � baixa, visto que a maioria dos pacientes neste estudo apresentou mucosa h�gida. Esse facto pode estar relacionado com nossa baixa casu�stica ou ainda � baixa toxicidade dos protocolos adotados e equipa odontol�gica atuante na Institui��o.
Palavras-chave: Inf�ncia, Leucemia-linfoma de c�lulas B, Leucemia-linfoma de c�lulas T, Manifesta��es bucais, Mucosa bucal,Quimioterapia de indu��o
�
Abstract
Objectives: To clinically evaluate the buccal mucosa of infant-juvenile patients diagnosed with lymphoblastic leukemia.
Methods: Within 12 months, 36 patients aged between 1 and 14 years old who were diagnosed with B- or T-cell precursor lymphoblastic leukemia and treated under GBTLI-LLA 2009 or ALL IC-BFM 2009 protocols were consecutively enrolled. The buccal mucosa was clinically evaluated at the beginning of the prophase/induction phase of chemotherapy and after 15 days of treatment.
Results: The 25 patients whose buccal mucosa was evaluated had a median age of 6.9 years old, and 64% (n=16) were male. The majority had B-cell precursor lymphoblastic leukemia (96%; n=24). Eleven of them (44% n=11) showed buccal manifestations, mostly at the beginning of the prophase/induction phase. The manifestations and their respective frequency were petechiae (31.6%; n=6), dry lips (26.3%, n=5), and buccal mucositis (15.8%, n=3). Non-keratinized mucosa was the preferred site (84.2%, n=16).
Conclusions: Buccal manifestations have a low frequency in infant-juvenile patients with lymphoblastic leukemia, as most patients in this study showed healthy mucosa. This finding could be due to our small sample or the low toxicity of the protocols and the dental team present at the Institution.
Keywords: Childhood,Precursor B-cell lymphoblastic,leukemia-lymphoma, Precursor T-cell lymphoblastic, leukemia-lymphoma,Oral manifestations,Mouth mucosa,Induction chemotherapy
�
Introdu��o
As leucemias linfobl�sticas s�o caracterizadas por disfun��o das c�lulas progenitoras hematopo�ticas da medula �ssea que culminam na prolifera��o clonal desordenada das c�lulas precursoras de origem linfoide.1 No caso da leucemia linfobl�stica (LL), a transforma��o maligna ocorre nos progenitores das c�lulas do tipo B e/ou T, causando ac�mulo de c�lulas bl�sticas preferencialmente na medula �ssea.2
Segundo dados da IARC (Ag�ncia Internacional de Pesquisa em C�ncer), estima‑se que as leucemias contabilizem, em m�dia, 30% de todos os diagn�sticos de neoplasias malinas entre 0 e 19 anos, configurando assim o c�ncer mais comum da inf�ncia e adolesc�ncia.3
Especificamente na regi�o Norte do Brasil, de acordo com a Funda��o de Hematologia e Hemoterapia do Amazonas (HEMOAM), entre 2005 e 2015 foram registrados 511 casos de LL em pacientes de 0 a 20 anos, predominantemente do sexo masculino. Dentre seus subtipos, a LL‑B � a prevalente, com 85% comparados com os casos de linhagem T.4
As LLs causam insufici�ncia hematopo�tica progressiva e fatal quando n�o contidas. Entretanto, s�o frequentemente quimiossens�veis, com taxas de sobrevida pr�ximas aos 90% se implementado o regime terap�utico ideal.5, 6 No Brasil, dois dos principais protocolos terap�uticos adotados s�o o do Grupo Brasileiro de Tratamento da Leucemia da Inf�ncia (GBTLI) e do Grupo Europeu Berlim‑Frankfurt‑Munster (BFM).7, 8
Os pacientes diagnosticados com LL podem apresentar uma gama de manifesta��es bucais inerentes � pr�pria doen�a de base e/ou ao seu tratamento. Referente � doen�a em si, a pr�pria altera��o da condi��o hematol�gica pode expor o paciente a tal desfecho. Quanto ao tratamento, a vulnerabilidade do paciente d�‑se em decorr�ncia do potencial mucot�xico pr�prio dos quimioter�picos, que t�m como c�lulas‑alvo as produzidas na medula �ssea, com taxa mit�tica semelhante �s c�lulas da mucosa bucal.9 ‑ 11
Tais manifesta��es, quando presentes, s�o capazes de sugerir os sinais e sintomas iniciais da doen�a e podem primeiramente ser reconhecidas pelo cirurgi�o‑dentista, em especial o odontopediatra, o qual dever� referenciar esse paciente ao adequado servi�o de diagn�stico e tratamento.9, 10, 12 Dentre as manifesta��es bucais mais frequentes das LLs est�o a mucosite bucal, candid�ase bucal, periodontite e gengivite. Os locais de surgimento mais frequentes s�o as �reas de mucosa bucal n�o‑queratinizada. 10
Dessa maneira, o objetivo desta pesquisa � trazer informa��es acerca das manifesta��es bucais de pacientes infanto-juvenis em dois momentos do tratamento quimioter�pico, provenientes do �nico servi�o p�blico de refer�ncia no tratamento de leucemias no Amazonas.
Material e m�todos
Esta pesquisa foi aprovada pelo Comit� de �tica em Pesquisa da Funda��o HEMOAM. Foi utilizado o checklist STROBE �Strengthening the Reporting of Observational Studies in Epidemiology para organiza��o da pesquisa.13 Trata‑se de pesquisa observacional em pacientes infantojuvenis.
Foram inclu�dos pacientes entre 1 e 18 anos, de ambos os sexos, diagnosticados com LL de c�lulas B ou T entre setembro/2018 e agosto/2019 prestes a iniciar o tratamento antineopl�sico na Funda��o HEMOAM, portanto, representando amostra de conveni�ncia. O tratamento ocorreu sob dois protocolos terap�uticos que estiveram vigentes ao longo da coleta � o proposto pelo Grupo Brasileiro de Tratamento de Leucemia da Inf�ncia (GBTLI LLA‑2009)7 e Grupo Alem�o Berlim‑Frankfurt‑Munique (ALL IC‑BFM2009).8
Foram exclu�dos do estudo pacientes que j� haviam iniciado o tratamento quimioter�pico, casos reiniciados por reca�da da doen�a, pacientes sindr�micos, presen�a do cromossoma Philadelphia, pacientes que foram a �bito ou transferidos para outro hospital no per�odo da pr�‑fase/indu��o do tratamento. Dessa maneira, foram considerados 25 pacientes eleg�veis para a pesquisa, conforme Figura 1.
�
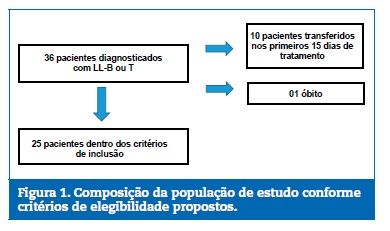
�
A mucosa bucal dos pacientes foi avaliada clinicamente no primeiro (D0/D1) e no d�cimo quinto dia (D15) da pr�‑fase/indu��o do tratamento quimioter�pico, conforme fluxograma apresentado na Figura 2. O procedimento foi executado por �nico examinador cirurgi�o‑dentista, especialista em odontopediatria, seguindo‑se a sequ�ncia de exame cl�nico preconizada pela disciplina de Estomatologia Cl�nica da Faculdade de Odontologia da Universidade Federal do Amazonas (FAO/UFAM). Foram analisados na sequ�ncia l�bios, mucosas, l�ngua, assoalho bucal, palato duro, palato mole, orofaringe e gengiva. O exame foi realizado com o paciente posicionado sentado ou em dec�bito dorsal. Para o exame foram utilizadas� esp�tulas de madeira e gaze com o cumprimento de todas as normas de biosseguran�a.14 Os registros foram feitos em ficha customizada para esse fim. A mucosite bucal foi graduada conforme sua gravidade (de 1 a 4) de acordo com a Escala de Toxicidade Oral da OMS,15 como mostrado na Tabela 1. O examinador foi calibrado por um cirurgi�o‑dentista atuante na Institui��o quanto ao diagn�stico da gravidade da mucosite bucal. Em raz�o da baixa casu�stica, foi realizada a an�lise estat�stica descritiva dos dados.
�
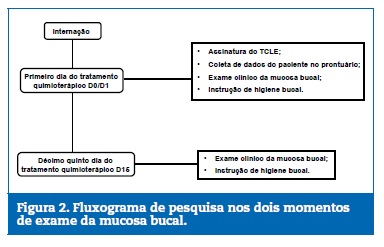
�
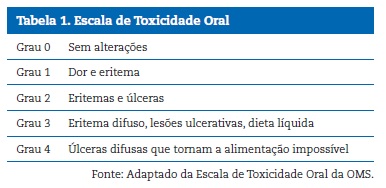
�
Resultados
Da amostra, 64% (n=16) eram do sexo masculino, com todos os pacientes entre 1 e 14 anos. A m�dia de idade ao diagn�stico foi de 6,9 anos e mediana de 5,5 anos, com maior frequ�ncia de LL provenientes de c�lulas B (96% n=24). Todos os pacientes eram residentes do Estado do Amazonas, sendo 92% (n=23) nascidos no mesmo Estado e 8% (n=2) naturais de outros Estados da regi�o norte. Quanto ao protocolo terap�utico, 36% (n=9) foram tratados pelo protocolo GBTLI LLA‑2009 e 64% (n=16) foram tratados sob protocolo ALL IC‑BFM 2009.
Informa��es de acordo com o sexo, idade, tipo de LL, protocolo utilizado, grupo de risco e manifesta��es bucais durante a pr�‑fase/indu��o do tratamento quimioter�pico dos 25 pacientes avaliados no estudo est�o apresentados na Tabela 2.
�
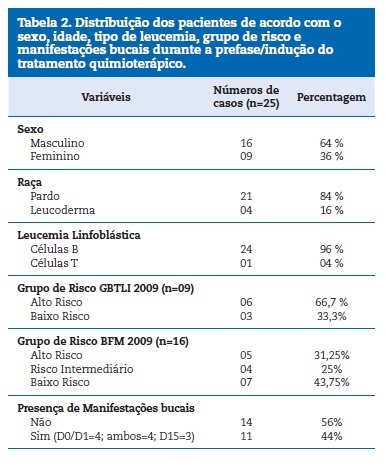
�
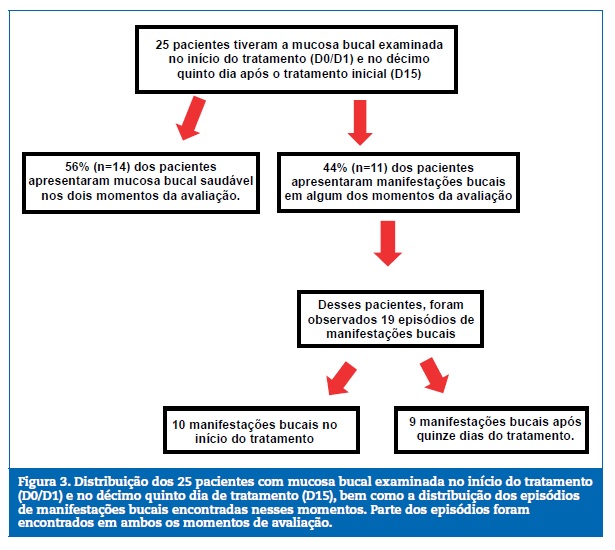
Desses pacientes, 56% (n=14) apresentaram mucosa h�gida, enquanto 44% (n=11) mostraram manifesta��es bucais.
Estes somaram 19 ocorr�ncias de manifesta��es bucais, sendo 52,6% (n=10) envolvendo o in�cio do tratamento (D0/D1) (Figura 3). De maneira mais detalhada, quanto � distribui��o dos achados, seis manifesta��es orais foram encontradas somente no D0/D1, distribu�das em 4 pacientes. Outras nove (09) manifesta��es aconteceram em 4 pacientes tanto em D0/D1 quanto D15. Ainda, quatro (04) manifesta��es bucais ocorreram somente em D15, distribu�das entre 3 pacientes, conforme Tabela 3.
�
�
�
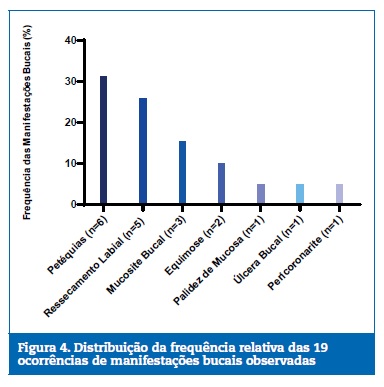
Quanto aos tipos e frequ�ncia das ocorr�ncias de manifesta��es bucais, foram encontradas em ordem decrescente, pet�quias (31,6%; n=6), ressecamento labial (26,3%; n=5), mucosite bucal (15,8%;n=03), equimose (10,5%; n=2) e palidez de mucosa, �lcera bucal e pericoronarite (5,3%;n=01 cada). A Figura 4 mostra a frequ�ncia desses achados.
�
�
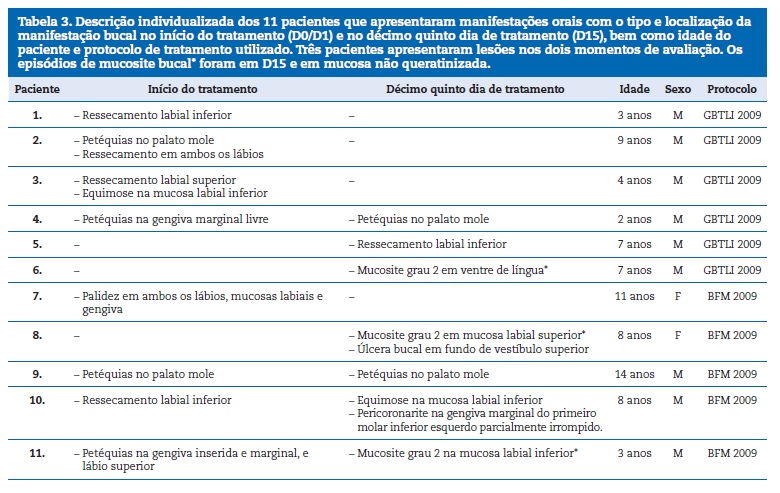
A localiza��o anat�mica das manifesta��es foram l�bios superior e inferior, mucosa labial, gengiva, palato mole, fundo de vest�bulo labial e ventre lingual, sendo a mucosa n�o‑queratinizada o s�tio de predile��o (84,2%, n=16). A Tabela 3 detalha todas as ocorr�ncias de manifesta��es bucais com seus respetivos s�tios anat�micos, al�m de idade dos pacientes e protocolo de tratamento utilizado.
Discuss�o
As leucemias linfobl�sticas contabilizam, em m�dia, 30% de todos os diagn�sticos de neoplasias entre 0 e 14 anos e tem o maior impacto no total da incid�ncia de c�ncer em pacientes infantojuvenis.3 Esse dado est� em concord�ncia com nosso estudo e nenhum paciente inclu�do tinha mais de 15 anos.
Em artigo com dados epidemiol�gicos sobre leucemias agudas no Estado do Amazonas de 2005 a 2015, dos 843 pacientes da pesquisa, 68,45% (n=577) foram diagnosticados com LL.
Desses, 91% (n=459) foram diagnosticados com LL de c�lulas B, enquanto 9% (n=52) foram diagnosticados com LL de c�lulas T.4 Esses valores est�o proporcionalmente em concord�ncia com os achados de nossa pesquisa, dado que dos 25 pacientes inclu�dos, n=16 (96%) tinham diagn�stico de LL‑B e n=1 (4%) LL‑T.
Est� bem estabelecido na literatura que a ocorr�ncia de mucosite bucal est� relacionada � toxicidade dos medicamentos utilizados na quimioterapia, especialmente o Metotrexato,16, 17 presente nos protocolos em concentra��es e frequ�ncias variadas. No entanto, n�o podemos afirmar o mesmo em rela��o as outras manifesta��es relatadas neste estudo. N�o se evidencia na literatura se as outras manifesta��es bucais poderiam representar les�es inespec�ficas, ou directamente sequela do tratamento ou se poderiam estar relacionadas � pr�pria doen�a de base. De maneira geral, os estudos s�o costumeiramente realizados em pacientes j� sob tratamento antineopl�sico.10, 18, 19
A mucosite bucal foi raramente verificada neste estudo, havendo, principalmente, a presen�a de outras manifesta��es bucais inespec�ficas, como pet�quias, l�bios ressecados, equimose, palidez de mucosa e pericoronarite. A ocorr�ncia de mucosite bucal em pacientes leuc�micos tratados exclusivamente por quimioterapia costuma ser mais baixa do que naqueles que tamb�m est�o recebendo radioterapia e/ou transplante de medula �ssea.20 De maneira geral, a mucosite bucal tem sido relatada em 40% ou mais dos pacientes com leucemia.16, 20 ‑ 22
A presen�a de pet�quias em mucosa bucal foi descrita na literatura por alguns pesquisadores em palato mole e mucosa bucal.16, 19, 23 Embora Gandhi et al.16 tenham observado essa manifesta��o bucal em 22,6% (n=14) dos pacientes recebendo quimioterapia para diversas neoplasias, Ponce‑Torres et al.19 examinando pacientes em tratamento para leucemia linfobl�stica, encontraram frequ�ncia maior, 35,7% (n=17) nessa popula��o. A presen�a de l�bios ressecados em pacientes quimioter�picos tamb�m � relatada na literatura, como Ponce‑Torres et al.19que identificaram essa condi��o em 93,8% (n=46) de sua amostra. O ressecamento labial pode estar correlacionado a outros fatores al�m da quimioterapia, possivelmente a permanente exposi��o dos pacientes institucionalizados ao ar condicionado.24
A equimose em mucosa labial de pacientes com leucemia tamb�m foi relatada, com frequ�ncias variando de 25% (n=8) a 36,73% (n=18).17, 21 Al�m disso, outras manifesta��es foram descritas ao longo do tratamento quimioter�pico desses pacientes.
A palidez de mucosa foi encontrada em 43,4% (n=9) e 31,25% (n=10).21, 23 Al�m disso, o acometimento por infec��es bucais (f�ngicas, virais ou bacterianas) em pacientes recebendo quimioterapia � um achado frequente.10, 16, 25, 26 No presente trabalho tais manifesta��es bucais podem representar achados ocasionais.
Em recente publica��o de s�rie de casos realizada na mesma Institui��o de nossa pesquisa, altera��es bucais foram observadas em 3 de 9 pacientes com LL‑B sob tratamento pelo protocolo GBTLI‑LLA 2009, sendo elas eritema, l�bios ressecados e epis�dio de xerostomia.27
Concernente ao local de apresenta��o dessas manifesta��es bucais, nossos achados s�o coerentes com a literatura,� que relata �reas de mucosa n�o‑queratinizada tais como mucosa labial, mucosa bucal, palato mole, superf�cie ventral e lateral da l�ngua como s�tio de predile��o dessas les�es.10, 28, 29
Neste estudo foi escolhida a pr�‑fase/indu��o para avalia��o dos pacientes em raz�o da maior possibilidade de manifesta��es bucais nessa etapa do tratamento devido a imediata mucotoxicidade das drogas quimioter�picas utilizadas nessa fase. V�rios autores tamb�m elegeram a primeira fase do tratamento para avalia��o bucal.10, 17, 23, 30 Al�m disso, durante esta pesquisa, dois protocolos de tratamento quimioter�pico foram adotados. Em setembro/2018 os pacientes eram tratados sob o protocolo GBTLI LLA‑2009, no qual at� o D15, s�o usadas as medica��es Prednisona, Metotrexato, Dexametasona, L‑Asparaginase, Vincristina, Daunorrubicina e Ara‑c (Citarabina). Para os grupos de alto e baixo risco de reca�da s�o usadas as mesmas medica��es, por�m em dosagens e momentos diferentes.7 Em janeiro de 2019 este protocolo foi temporariamente suspenso e at� o final desta pesquisa, em agosto/2019, os pacientes passaram a ser tratados pelo protocolo
ALL IC‑BFM 2009, amplamente utilizado em grandes centros de tratamento pelo mundo. De forma semelhante, esse protocolo faz uso da Prednisona, Vincristina, Daunorrubinina, L‑Asparaginase e Metotrexato. A dura��o da indu��o nessa terap�utica � de 33 dias.8
Atualmente, na busca de um tratamento mais completo para o paciente, os cuidados bucais ocupam lugar estrat�gico na terapia de suporte. Com isso, refor�a‑se o sentido do especialista em odontopediatria desempenhando fun��o estrat�gica dentro da equipe multidisciplinar que assiste o paciente com leucemia.9, 11, 12 O HEMOAM possui equipe odontol�gica atuante para manejo dos pacientes em tratamento quimioter�pico.
As limita��es encontradas no presente trabalho referem‑se principalmente a baixa casu�stica, ao tipo de amostra � de conveni�ncia � oriunda de �nico centro de tratamento e tamb�m a prov�vel exclus�o de pacientes transferidos para outros hospitais da cidade pela necessidade de unidade para terapia intensiva (UTI), em fun��o de agravamento da doen�a. Alguns desses casos est�o relacionados a pacientes com LL‑T, cuja gravidade costuma ser maior que o de c�lulas B, o que limitou nosso acesso a esses pacientes.5 Em virtude das limita��es encontradas nesse estudo, essa amostra pode n�o ser representativa dos pacientes com LL de c�lulas B ou T. Dessa maneira, a baixa ocorr�ncia de manifesta��es bucais pode estar relacionada tanto � quantidade e perfil de pacientes alocados no estudo quanto � prov�vel baixa toxicidade dos protocolos utilizados.
O presente estudo trouxe informa��es epidemiol�gicas e de perfil de manifesta��es bucais encontradas em pacientes infantojuvenis com leucemia linfobl�stica em um centro de refer�ncia em hematologia do norte do Brasil.
Conclus�es
Os achados de mucosite bucal, classicamente verificada na literatura como sequela do tratamento em pacientes com leucemia, foi incipiente nesta pesquisa, estando outras manifesta��es bucais inespec�ficas encontradas em baixa frequ�ncia.
Este perfil pode estar relacionado � baixa casu�stica da pesquisa, bem como � prov�vel baixa toxicidade dos protocolos adotados, ou ainda � atua��o da equipe odontol�gica na Institui��o, o que poderia favorecer a preven��o de agravos bucais.
�
Refer�ncias
1. Hoffbrand AV, Moss PAH, Pettit JE. Fundamentos em hematologia. 7.a ed. Porto Alegre, RS: ARTMED, 2018.
2. Zuckerman T, Rowe JM. Pathogenesis and prognostication in acute lymphoblastic leucemia. F1000Prime Rep. 2014;6:59.
3. Steliarova‑Foucher E, Colombet M, Ries LAG, Moreno F, Dolya A, Bray F, et al. International incidence of childhood cancer, 2001‑10: a population‑based registry study. Lancet Oncol. 2017;18:719‑31.
4. Silva‑Junior AL, Alves FS, Kerr MWA, Xabregas LA, Gama FM, Rodrigues MGA, et al. Acute lymphoid and myeloid leukemia in a Brazilian Amazon population: Epidemiology and predictors of comorbidity and deaths. PLoS One. 2019;14:e0221518.
5. Kato M, Manabe A. Treatment and biology of pediatric acute lymphoblastic leukemia. Pediatr Int. 2018;60:4‑12.
6. Oskarsson T, Soderhall S, Arvidson J, Forestier TL, Hellebostad M, Lahteenmaki M, et al. Treatment‐related mortality in relapsed childhood acute lymphoblastic leukemia. Pediatr Blood Cancer. 2017;65(4):e26909.
7. Sociedade Brasileira de Oncologia Pediatrica. Protocolo Brasileiro de tratamento da leucemia linfoide aguda na infancia GBTLI LLA‑2009. Sao Paulo: Campinas; 2011;1‑347.
8. ALL IC‑BFM 2009. A Randomized Trial of the I‑BFM‑SG for the Management of Childhood non‑ B Acute Lymphoblastic Leukemia. [Disponivel em: http://www.bialaczka.org/wp‑content/uploads/2016/10/ALLIC_BFM_2009.pdf � Acedido em 05‑05‑2019].
9. Lowal KA, Alaizari NA, Tarakji B, Petro W, Hussain KA, Altamimi MAA, et al. Dental considerations for leukemic pediatric patients: an updated review for general dental practitioner. Mater Sociomed. 2015;27:359‑62.
10. Freitas de Morais EF, Lira JAS, Macedo RAP, Santos KS, Elias CTV, Morais MLSA. Oral manifestations resulting from chemotherapy in children with acute lymphoblastic leucemia. Braz J Otorhinolaryngol. 2014.80:78‑85.
11. Javed F, Utreja A, Bello Correa FO, Al‑Askar M, Hudieb M, Qayyum F, Al‑Rasheed A, Almas K, Al‑Hezaimi K. Oral health status in children with acute lymphoblastic leucemia. Crit Rev Oncol Hematol. 2012;83:303‑9.
12. Cuschieri S. The STROBE guidelines. Saudi J Anaesth. 2019;13(Suppl 1):S31‑S34.
13. Minist�rio da Sa�de, 2006. Servi�os Odontol�gicos. Preven��o e Controle de Riscos. Agencia Nacional de Vigil�ncia Sanit�ria, Brasil: Bras�lia; 2006. [Dispon�vel em: http://www.anvisa.gov.br/servicosaude/manuais/manual_odonto.pdf � Acedido em 02/01/2020]
14. World Health Organization. Handbook for Reporting Results of Cancer Treatment. World Health Organization, Switzerland: Geneva, 1979. [Disponivel em: https://apps.who.int/iris/handle/10665/37200 � Acedido em 01‑06‑2019]
16. Gandhi K, Datta G, Ahuja S, Saxena T, G Datta A. Prevalence of Oral Complications occurring in a Population of Pediatric Cancer Patients receiving Chemotherapy. Int J Clin Pediatr Dent. 2017;10:166‑71.
17. Garrocho‑Rangel JA, Herrera‑Moncada M, Marquez‑Preciado R, Tejeda‑Nava F, Ortiz‑Zamudio JJ, Pozos‑Guillen A. Oral mucositis in paediatric acute lymphoblastic leukemia patients receiving methotrexate‑based chemotherapy: case series. Eur J Paediatr Dent. 2018;19:239‑42.
18. Mendonca RMH, de Araujo M, Levy CE, Morari J, Silva RA, Yunes JA, et al. Prospective evaluation of HSV, Candida spp., and oral bacteria on the severity of oral mucositis in pediatric acute lymphoblastic leukemia. Support Care Cancer. 2012;20:1101‑7.
19. Ponce‑Torres E, Ruiz‑Rodriguez MS, Alejo‑Gonzalez F, Hernandez‑Sierra JF, Pozos‑ Guillen AJ. Oral manifestations in pediatric patients receiving chemotherapy for acute lymphoblastic leukemia. J Clin Pediatr Dent. 2010;34:275‑9.
20. Ritwik P. Dental Care for Patients With Childhood Cancers. Ochsner J. 2018;18:351‑7.
21. Parra JJ, Alvarado MC, Monsalve P, Costa ALF, Montesinos GA, Parra PA. Oral health in children with acute lymphoblastic leukaemia: before and after chemotherapy treatment. Eur Arch Paediatr Dent. 2020;21:129‑36.
22. Aggarwal A, Pai KM. Orofacial Manifestations of Leukemic Children on Treatment: A Descriptive Study. Int J Clin Pediatr Dent. 2018;11:193‑8.18.
23. Lula ECO, Lula CEO, Alves CM, Lopes FF, Pereira AL. Chemotherapy‑induced oral complications in leukemic patients. Int J Pediatr Otorhinolaryngol. 2007;71:1681‑5.
24. Paiva‑Neto GO. Leucemia linfoblastica de c�lulas B (LLL‑ B): incid�ncia de agravos bucais e �ndices hematol�gicos em pacientes pedi�tricos em tratamento pelo protocolo GBTLI LLA‑ 2009. Disserta��o. (Programa de P�s‑Gradua��o Em Odontologia) � Universidade Federal do Amazonas, Manaus. 2018.
25. Mendonca RM, Araujo Md, Levy CE, Morari J, Silva RA, Yunes JA, et al. Oral Mucositis in Pediatric Acute Lymphoblastic Leukemia Patients: Evaluation of Microbiological and Hematological Factors. Pediatr Hematol Oncol. 2015;32:322‑30.
26. Kamasaki Y, Satoh K, Nishiguchi M, Hoshino T, Fujiwara T. Acute oral complications in a pediatric patient with acute lymphoid leukemia. Pediatr Int. 2016;58:484‑7.
27. Oliveira JMS, Pereira JV, Lira EC, Santos CMB, Paiva‑Neto GO, Liborio‑Kimura TN. Evaluation of the buccal mucosa of patients with acute lymphocytic leukemia: A case series study. Rev Port Estomatol Med Dent Cir Maxilofac. 2019;60:163‑8.
28. Ribeiro ILA, Limeira RRT, Dias de Castro R, Ferreti Bonan PR, Valenca AMG. Oral Mucositis in Pediatric Patients in Treatment for Acute Lymphoblastic Leukemia. Int J Environ Res Public Health. 2017;14:1468.
29. Padmini C, Bai KY. Oral and Dental Considerations in Pediatric Leukemic Patient. ISRN Hematol. 2014;2014:895721.
30. Subramaniam P, Babu KL, Nagarathna J. Oral Manifestations In Acute Lymphoblastic Leukemic Children Under Chemotherapy. J Clin Pediatr Dent. 2008;32:319‑24.
�
Tatiana Nayara Lib�rio Kimura
Correio eletr�nico: tliborio@ufam.edu.br, tatiana.liborio@gmail.com
�
Responsabilidades �ticas
Prote��o de pessoas e animais. Os autores declaram que para esta investiga��o n�o se realizaram experi�ncias em seres humanos e/ou animais.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca do acesso aos dados de pacientes e sua publica��o.
Direito � privacidade e consentimento escrito. Os autores declaram que n�o aparecem dados de pacientes neste artigo.
�
Conflito de interesses
Os autores declaram n�o haver conflito de interesses.
�
Agradecimentos
Este estudo foi realizado com recursos pr�prios dos pesquisadores. Os autores agradecem o apoio do Programa de P�s-Gradua��o em Ci�ncias Aplicadas � Hematologia e a todos os setores envolvidos da Funda��o de Hematologia e Hemoterapia do Amazonas � HEMOAM.
�
Historial do artigo:
Recebido a 30 de janeiro de 2020
Aceite a 24 de outubro de 2020
On-line a 16 de novembro de 2020
