
Revista Portuguesa de Estomatologia, Medicina Dentária e Cirurgia Maxilofacial
SPEMD | 2017 | 58 (4) | 225-230
Investigação Original
Avaliação periodontal em crianças e adolescentes com Diabetes Mellitus tipo 1: estudo caso-controlo
Periodontal assessment in children and adolescents with type 1 diabetes mellitus: a case-control study
a Universidade Federal de Pernambuco (UFPE), Centro de Ciências da Saúde, Pernambuco, Brasil
b Centro Universitário Maurício de Nassau, Pernambuco, Brasil
c Universidade de Pernambuco (UPE), Pernambuco, Brasil
d Universidade Federal Rural de Pernambuco(UFRPE), Pernambuco, Brasil
Ana Carolina de Souza Leitão - carolinalfalcao@hotmail.comcarolinalfalcao@hotmail.com
Article Info
Rev Port Estomatol Med Dent Cir Maxilofac
Volume - 58
Issue - 4
Investigação Original
Pages - 225-230
Go to Volume
Article History
Received on 14/09/2017
Accepted on 03/03/2018
Available Online on 04/04/2018
Keywords
Investigação original
Avaliação periodontal em criancas e adolescentes com Diabetes Mellitus tipo 1: estudo caso-controlo
Periodontal assessment in children and adolescents with type 1 diabetes mellitus: a case-control study
Ana Carolina de Souza Leitãoa,b,*,Erinaldo Ubirajara Damasceno dos Santosc, Paulo Roberto Eleutério de Souzac,d, Renata Cimõesa
a Universidade Federal de Pernambuco (UFPE), Centro de Ciências da Saúde, Pernambuco, Brasil
b Centro Universitário Maurício de Nassau, Pernambuco, Brasil
c Universidade de Pernambuco(UPE), Pernambuco, Brasil
dUniversidade Federal Rural de Pernambuco(UFRPE), Pernambuco, Brasil
http://doi.org/10.24873/j.rpemd.2017.02.213
RESUMO
Objetivo: Comparar a condição periodontal entre crianças e adolescentes com diabetes tipo 1 com pacientes saudáveis.
Métodos: Foi realizado um estudo caso-controlo. 160 pacientes entre 6 e 13 anos foram submetidos ao exame clínico periodontal, sendo 60 casos e 100 controlos. O nível de inserção clínica (NIC), a profundidade à sondagem (PS), o sangramento à sondagem (SS) e a presença de placa visível (IPV) foram registados. Valores atualizados da hemoglobina glicada (HbA1c) dos pacientes com diabetes foram anotados e comparados aos demais dados. Para as análises estatísticas foram empregados o teste Qui-quadrado de Pearson e o de razão de Verossimilhança. Para a comparação das médias de idade entre os grupos foi utilizado o teste de Mann Whitney. O Software utilizado foi o SPSS 20.0.
Resultados: Os pacientes do grupo controlo apresentaram maior índice de placa visível (72,52%) e maior profundidade de sondagem (30,90%), nos sítios examinados. Os pacientes com DM1 apresentaram maior número de sítios com sangramento à sondagem (9,56%) e uma associação positiva entre hemorragia à sondagem e controlo glicémico inadequado, o que foi estatisticamente significante (p<0,001).
Conclusões: Neste estudo, crianças e adolescentes do grupo caso e controlo não foram diagnosticadas com doença periodontal. Apresentaram fatores de risco: alto índice de placa visível e o grupo caso ainda apresentou baixo controlo glicémico. Futuros estudos coorte são necessários para melhor esclarecer a etiopatogénese da doença.
Palavras-chave: Diabetes tipo 1, Gengivite, Periodontite
ABSTRACT
Objective: To compare the periodontal condition of children and adolescents with type 1 diabetes with that of healthy patients.
Methods: A case-control study was carried out. 160 patients, 60 tests and 100 controls, aged 6 to 13 years underwent clinical periodontal examination. The clinical attachment level (CAL), probing depth (PD), bleeding on probing (BOP) and presence of visible plaque (IPV) were recorded. Updated values of glycated hemoglobin (HbA1c) in patients with diabetes were recorded and compared to the others. The Pearson's chi-square test and the likelihood ratio test were used for statistical analysis. The Mann Whitney test was used to compare the mean values of age between groups. The software used was SPSS 20.0.
Results: Patients in the control group had higher visible plaque index (72.52%) and greater probing depth (30.90%) in the sites examined. Patients with DM1 had a higher number of sites with bleeding (9.56%) and a positive association between probing hemorrhage and inadequate glycemic control, which was statistically significant (p<0.001).
Conclusions: Children and adolescents from the test and control groups were not diagnosed with periodontal disease. However, risk factors were found: high visible plaque index and, in the test group, low glycemic control. Future cohort studies are needed to elucidate the etiopathogenesis of the disease better.
Keywords: Type 1 diabetes, Gingivitis, Periodontitis
Introdução
O diagnóstico de doenças sistémicas e metabólicas, em muitos casos, acontece nos primeiros anos de vida. Crianças passam a ser acompanhados por equipes multidisciplinares, com médicos especialistas, nutricionistas, psicólogos, entre outros, mas quase sempre, não recebem atenção odontológica adequada. A condição bucal negligenciada, no entanto, representa risco ao desenvolvimento de várias infeções, que podem, por si, comprometer o quadro clínico geral.1
Pacientes com Diabetes Mellitus (DM) têm despertado uma atenção peculiar aos odontólogos. Estima‑se uma população mundial de 387 milhões de indivíduos diagnosticados com a doença metabólica,2 com perspetivas de 9 bilhões no mundo, em 2040.3 O diabetes tipo 1 (DM1) representa de 5 a 10% dos casos e é o mais comum entre crianças e adolescentes, caracterizado por reação autoimune, com a destruição das células beta das ilhotas de Langerhans pancreáticas; ou de etiologia idiopática, usualmente levando à deficiência completa de insulina. 4 , 5 Pacientes podem desenvolver problemas visuais, cerebrais, renais, cardiovasculares, e em casos mais graves, chegar a óbito, isto pode ocorrer, na falência de órgãos vitais.3 As alterações bucais também podem ser observadas, como: queiloses, fissuras, ressecamento de mucosas, síndrome da ardência bucal, cáries, dificuldades de cicatrização, além de alterações na microbiota.6‑8
Entre as repercussões bucais, as periodontopatias são as mais citadas, com prevalência de 39% na DM1 e em pacientes com diabetes tipo 2, apresentam 2,8 vezes maior probabilidade de desenvolver a doença, quando comparados a grupos controlo.8 Pacientes com DM podem apresentar: elevação dos níveis de glicose, cálcio, potássio e magnésio, além da diminuição no fluxo e capacidade tampão salivares; diminuição da atividade dos neutrófilos; além de incompetências microvasculares; que predispõem a danos teciduais e a uma resposta inadequada frente a quadros infecciosos. 6 , 9 ‑ 12
A elevação plasmática de citocinas, por outro lado, é capaz de promover resistência à insulina, o que pode comprometer as condições gerais do paciente. 12 ‑ 24
Uma melhor compreensão das manifestações bucais nestes pacientes, desde a infância, pode orientar a intervenção odontológica precoce, minimizando riscos e facilitando os tratamentos. Através do estudo caso‑controlo, buscou‑se identificar a condição periodontal de crianças e adolescentes com DM1, e comparar resultados com pacientes sem diabetes.
Materiais e métodos
A pesquisa foi realizada com uma amostra aleatória não probabilística.
A fim de manter a homogeneidade dos grupos, com semelhantes níveis socioeconómicos, foram seleccionados serviços que realizam atendimento de saúde gratuito à população, localizados na mesma cidade. O grupo caso foi formado por 60 pacientes com DM1, atendidos em dois hospitais públicos brasileiros. O grupo controlo, por 100 crianças atendidas na Clínica Escola do Centro Universitário Maurício de Nassau. O estudo foi aprovado pelo Comitê de Ética da UFPE sob o Parecer de N.º 912.145. Para os casos, foram seleccionados os pacientes entre 6 e 13 anos de idade, com diagnóstico de DM1 e com dentes permanentes em oclusão. Os valores atualizados da hemoglobina glicada (HbA1c) foram anotados. Crianças portadoras de outras alterações sistémicas ou que fizessem uso de aparelhos ortodônticos, não foram incluídas no estudo.
Para o grupo controlo, foram selecionadas crianças na mesma faixa etária, sem diagnóstico de doenças sistémicas e que apresentassem dentes permanentes em oclusão. Pacientes que fizessem uso de aparelhos ortodônticos também não entraram neste grupo.
O exame periodontal foi realizado com a utilização de odontoscópios e sondas manuais milimetradas (PC15, Universidade Carolina do Norte). Foram coletados os seguintes dados: Nível clínico de inserção (NIC); Profundidade à sondagem (PS), medida nos sítios: centro vestibular, mesio‑vestibular e disto‑vestibular e centro‑lingual, disto e mesio‑lingual, dos dentes permanentes em oclusão.25 Para o Sangramento à sondagem (SS) foi registada a presença ou ausência de sangramento, após 30 segundos transcorridos da profundidade de sondagem.25
Presença de placa visível (IPV): foi registada a presença ou ausência de placa bacteriana, sem utilização de sonda.25
A Doença periodontal foi classificada como: Gengivite, quando caracterizada pela presença de 25% ou mais de sítios com sangramento à sondagem e nenhum sítio com NIC > 2 mm.26 Periodontite, quando caracterizada pelo achado de pelo menos um sítio apresentando simultaneamente PS ≥ 4 mm e NIC ≥ 3 mm.24 Pacientes com hemoglobina glicada ≥ 7,0 % foram considerados com mal controlo glicémico.2
A pesquisadora realizou todos os exames clínicos periodontais nos pacientes do estudo. Previamente, foi calibrada por uma especialista em periodontia e comparados os dados coletados.
Foi verificado um coeficiente de correlação intraclasse (ICC), satisfatório para todas as análises (0,4 ≤ ICC < 0,75).
Para a análise dos dados, foram aplicados os testes de independência do Qui‑quadrado de Pearson e o de Razão de Verossimilhança.
Na comparação das médias de idade entre os grupos foi utilizado o teste de Mann Whitney. Valores de p menores que 0,05 foram considerados estatisticamente significantes.
O Software utilizado foi o SPSS 20.0.
Resultados
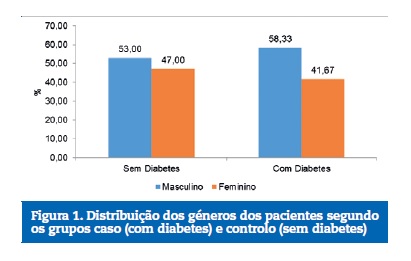
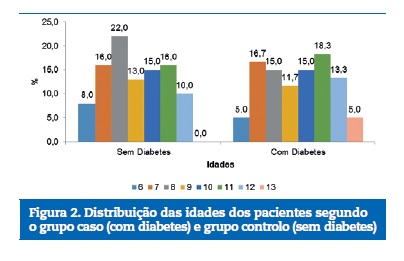
O sexo masculino foi predominante em ambos os grupos, sem diferença significante (p=0,512) (Figura 1). As crianças apresentaram diferentes idades, a maioria com 8 ou 11 anos, o que também não representou diferença significante (p=0,139) (Figura 2).
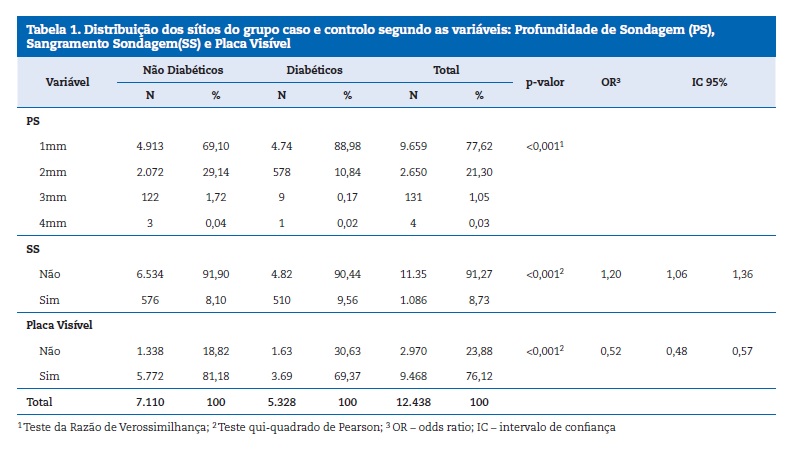
No exame clínico, foram avaliados os dentes permanentes em oclusão, com média de ± 5,97 a ± 7,25 dentes por pacientes casos e controlos, respetivamente. A maioria dos sítios examinados nos pacientes com DM1 apresentou PS igual a 1 mm
(88,98%). No grupo controlo, 29,14% apresentaram PS igual a 2 mm e em apenas 3 sítios, o resultado foi igual a 4 mm. A profundidade de sondagem, portanto, foi maior nos pacientes do grupo controlo e essa diferença foi estatisticamente significante (p≤0,05). Em relação ao SS, os pacientes com diabetes apresentaram 1,2 vezes mais chances de apresentar o sangramento, em relação aos pacientes sem diabetes(p≤0,05). O IPV foi mais presente nos pacientes sem diabetes (81,18%) do que nos pacientes com diabetes (69,37%) e essa diferença também foi estatisticamente significante (p≤0,05) (Tabela 1).
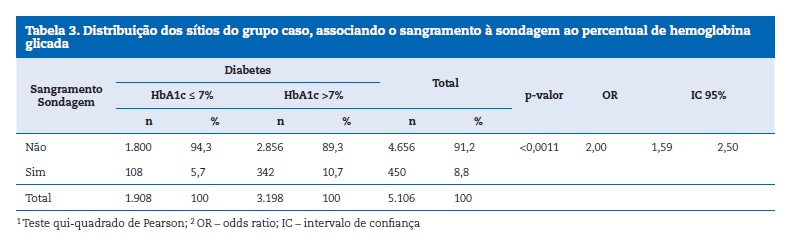
Foi observado um baixo controlo glicémico no grupo caso, com valores da HbA1c entre 8,71%, em média, chegando a 15% (Tabela 2). Quando foi considerado o SS e os valores da HbA1c, observou‑se que os pacientes com DM1 que apresentaram HbA1c > 7%, apresentaram um número 2 vezes maior de sangramento após sondagem, que os pacientes com níveis glicémicos compensados (Tabela 3).

Todos as crianças examinadas apresentaram o NIC dentro da normalidade. Após a análise de todos os dados, não foi diagnosticada doença periodontal entre os grupos.
Discussão
Para o desenvolvimento deste estudo, 160 crianças passaram pelo exame periodontal. O conhecimento das características e alterações de normalidade do periodonto são essenciais, a fim de que falsas patologias não fossem diagnosticadas. Na criança, ocorrem variações fisiológicas, como maior presença de fibras de colagénio, menor queratinização do tecido epitelial gengival; além de alterações ósseas, com espaços medulares maiores, maior vascularização e suprimento linfático, quando comparadas ao periodonto do paciente adulto. 1, 18, 19 É importante ressaltar, no entanto, que em crianças com diabetes, as alterações imunológicas, vasculares e metabólicas, representam fatores de risco. A suscetibilidade individual, o nível de controlo glicémico e de cuidados bucais poderão alterar características de normalidade, devendo ser avaliado o caso a caso.15
A Organização Mundial de Saúde considera a DP como a sexta complicação crónica do diabetes.8 Em pesquisa com 208 pacientes com a doença metabólica, foi diagnosticada a periodontite severa a partir dos 11 anos de idade, aumentando a incidência de perda óssea na puberdade e em até 26% dos casos, entre os 17 e 18 anos.23 Nenhum caso de doença periodontal, no entanto, foi diagnosticado entre os casos e controlos deste estudo. Diferenças entre as metodologias empregadas nas pesquisas podem justificar os resultados, com diferentes idades dos pacientes, critérios para diagnóstico ou diferentes dentições avaliadas.
Neste estudo, o exame do paciente consistiu na avaliação do NIC, PS, SS e IPV, com base nos dentes permanentes emoclusão; o que variou de 2 a 28 dentes por paciente, de acordo com a idade e a cronologia de erupção. Nos grupos com e semdiabetes, pacientes de ambos os sexos foram examinados, o que não comprometeu a interpretação dos resultados. De acordo com a literatura, alterações patológicas, como gengivites e periodontites, podem estar associadas ao sexo do indivíduo, contudo, influenciadas por alterações hormonais, principalmente femininas, como: na puberdade, gravidez emenopausa, hipóteses que, como regra, não correspondem à fase do ciclo vital ora estudada. 1 , 19 Por outro lado, o sexo masculino pode representar um fator de risco, quando aspectos socioculturais podem influenciar num menor cuidado com asaúde e higiene pessoal e ainda, a uma maior exposição ao tabaco e ao álcool. 19 , 23 Estudo em pacientes com DM1, entre 7 e 19 anos de idade, identificaram um percentual de indivíduos (62,8%) com presença de placa abundante e maior sangramento à sondagem, significativamente maior no género masculino.
Nesta pesquisa, no entanto, a relação com o género não foi significativa. Após o exame da PS, com base em critérios objetivos para diagnóstico, não foi identificada a presença de gengivite. Estudos epidemiológicos, contudo, indicam a presença da gengivite como achado comum em crianças. 27 , 28 Vários trabalhos que pesquisam a gengivite em crianças e adolescentes, no entanto, utilizam critérios subjetivos para o diagnóstico da doença e assim, apresentam diferentes resultados. De acordo com
Toledo,18 muitos vieses de confusão podem acontecer, pois o periodonto de crianças e adolescentes podem apresentar alteração de cor, volume e forma, associados a alterações fisiológicas nos períodos de esfoliação dos dentes ou erupção dentária, o que não é doença.
Apesar da ausência da inflamação, foi identificada a presença de placa visível na maioria dos pacientes. Nas crianças com DM1, em 69,37% das superfícies dentais, e na quase totalidade das faces, no grupo controlo (81,18%). O acúmulo e metabolismo de bactérias sobre tecidos dentais representam factores de risco para cáries, doenças periodontais e estomatites.18
O controlo do biofilme melhor nos pacientes com DM1 pode estar associado ao perfil dos examinados, crianças sob uma maior vigilância de higiene e dieta. No entanto, das 5.328 faces dentais examinadas, 3.696 apresentaram presença de placa visível nestes pacientes, sugere que ainda há muito o que se alertar, sobre a necessidade de uma atenção odontológica preventiva, também neste grupo.
Quando os resultados da PS foram comparados, observou‑se que os pacientes do grupo controlo, apresentaram maior comprimento entre a margem da gengiva e a porção mais apical do sulco, com 2 mm, em 29,14% dos pontos examinados; enquanto entre os pacientes com diabetes, apenas 10,80% apresentaram tal medida. A presença de maior acumulação de biofilme nas superfícies dentárias, achado entre o grupo controlo, já representa condição essencial para o desenvolvimento de alterações no periodonto. Contudo, os valores entre 1 e 2 mm da profundidade de sondagem, ainda são considerados dentro dos limites de normalidade, não representando quadros patológicos. 1 , 19
Numa revisão sistemática, após avaliados 37 estudos sobre a saúde oral de crianças com diabetes tipo 1, foi observado maior índice de placa e maior PS, entre os pacientes com a doença crónica, contudo, quando analisadas as pesquisas de corte, entre os artigos da revisão, não foram observadas diferenças com significância estatística, entre a condição periodontal de casos e controlos.29
As periodontopatias caracterizam‑se por um grupo de patologias que acometem os tecidos responsáveis pela protecção dos dentes e sua inserção no tecido ósseo alveolar, mandibular ou maxilar. 14 A etiopatogenia pode estar associada a processos inflamatórios, traumáticos, neoplásicos, alterações genéticas e metabólicas.27 Grupos de microorganismos anaeróbios no biofilme dental, no entanto, são conhecidos como os principais agentes etiológicos e a resposta do hospedeiro frente à infecção pode ser a principal responsável pelo dano tecidual.30 Nos pacientes com DM, deficiências na quimiotaxia, adesão e fagocitose dos neutrófilos facilitam a persistência e a proliferação de agentes patogênicos.31 De acordo com a literatura, observa‑se entre pacientes com diabetes, uma resposta mais exacerbada de monócitos e macrófagos, que pode ser induzida por uma maior concentração de mediadores inflamatórios no fluido gengival, refletindo numa maior atividade inflamatória local, nem sempre compatível com a quantidade ou qualidade e atividade do agente agressor.32
A manutenção da saúde da criança com DM1 representa um desafio diário. Na prevenção de quadros infecciosos e complicações, o controlo da glicémia é essencial.29 Baseia‑se na educação alimentar, que deve manter o padrão calórico e nutricional adequados ao crescimento e desenvolvimento normais; na insulinoterapia, que pode variar com relação às idades e necessidades individuais, com diferentes dosagens, tempo de ação e intervalos de administração a tratamentos através de bombas de infusão contínuas; além da actividade física regular. A automonitorização glicémica, com a medida da glicemia capilar e a dosagem da hemoglobina glicada são indicadas na monitorização e avaliação do paciente, permitindo ajustes e alterações nas dosagens e orientações, evitando complicações micro e macrovasculares e até danos neurológicos. 2 , 29
Nesta pesquisa, foram anotados os dados da HbA1c de todas as crianças do grupo dos casos. Os resultados variaram entre 4% à 15%, sendo a média de 8,71%, indicando assim, um grande número de pacientes com controlo glicémico inadequado.
De acordo com as orientações da Sociedade Brasileira de Diabetes (2015‑2016),2 um melhor controlo metabólico acontece com os níveis de HbA1c abaixo dos 7%. Nestes pacientes, observou‑se também, uma correlação entre a presença do sangramento após sondagem, com até 2 vezes mais chances de ocorrência, nos pacientes com valores da hemoglobina glicada acima dos níveis recomendados. Assim, apesar do não diagnóstico de gengivites ou periodontites nos pacientes examinados, nos pacientes com diabetes tipo 1 foram observados vários fatores de risco associados, como a má higiene bucal e a falta de controlo glicémico, situações que se não melhor conduzidas, a médio ou longo prazo podem resultar em doenças bucais, riscos de perdas dentais e uma piora na condição sistêmica. 6, 10, 11, 13, 14
A higiene adequada, tratamentos odontológicos preventivos, restauradores e cirúrgicos, quando indicados, devem fazer parte da rotina de tratamentos, com consultas periódicas, permitindo e corroborando para uma melhor qualidade de vida para estas crianças.
Conclusões
Neste estudo, as crianças do grupo caso e controlo não foram diagnosticadas com periodontopatias, contudo, apresentaram alto índice de placa visível, o que indicou a presença de má higiene bucal e assim, fator de risco a cáries e a danos às estruturas periodontais a médio e longo prazo. O grupo dos pacientes com DM1 apresentou baixo controlo glicémico associado à maior presença de sangramento após sondagem.
REFERÊNCIAS
1. Guedes‑Pinto AC, Mello‑Moura ACV. Odontopediatria. 9th ed. Rio de Janeiro: Santos, 2016.
2. Oliveira JEP, Vencio S editors. Diretrizes da Sociedade Brasileira de Diabetes (2015‑2016). São Paulo: A.C. Farmacêutica, 2016.
3. Ogurtsova K, da Rocha Fernandes JD, Huang Y et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 2017;128:40‑50.
4. Schneider C, Mossmann F, Coletti F, Possas M, Daudt M. Taxa de mortalidade e morbidade por diabetes mellitus. RBAC. 2009;41:287‑8.
5. Novotna M, Podzimek S, Broukal Z, Lencova E, Duskova J. Periodontal disease and dental caries in children with type 1 Diabetes Mellitus. Mediators Inflamm. 2015;2015:379626.
6. Vieira TR, Peret ACA, Peret‑Filho LA. Alterações periodontais associadas às doenças sistêmicas em crianças e adolescentes. Rev Paul Pediatr. 2010;28:237‑43.
7. Arheiam A, Omar S. Dental caries experience and periodontal treatment needs of 10‑to 15‑year old children with type 1 diabetes mellitus. Int Dent J. 2014;64:150‑4.
8. Costa CC, Resende GB, Souza JM, Tavares SS, Almeida ICSS, Filho LCC. Estudo das Manifestações bucais em crianças com diabetes e suas variáveis de correlação. Arq Bras Endocrinol Metab. 2004;48:374‑8.
9. Dias LZS, Piol SAC, Almeida CSL. Atual classificação das doenças periodontais. UFES Rev Odontol. 2006;8:59‑65.
10. Correia D, Alcoforado G, Mascarenhas P. Influência da Diabetes Mellitus no desenvolvimento da doença periodontal. Rev Port Estomatol Med Dent Cir Maxilofac. 2010;51:167‑76.
11. Alves C, Andion J, Brandão M, Menezes R. Mecanismos patogênicos da doença periodontal associada ao diabetes melito. Arq Bras Endocrinol Metab. 2007;51:1050‑7.
12. Oliveira RN, Corbi SCT, Bastos AS, Orrico SRP, Scarel‑Caminaga RM. Doença periodontal em pacientes com Diabetes Mellitus: influência de polimorfismos genéticos? Rev Odontol UNESP. 2011;40:187‑94.
13. Perez MMC, Lucena KCR, Souza PRE, CIMÕES R, LEAO JC. Analysis of the polymorphism of osteoprotegerin by polymerase chain reaction in patients with type 2 diabetes and the association with periodontal condition. RGO Ver Gaucg Odontol. 2013;61:99‑105.
14. Mealey BL. Periodontal disease and diabetes: a two‑way street. J Am Dent Assoc. 2006;137(Suppl):26S‑31S.
15. Xavier ACV, Silva IN, Costa FO, Corrêa DS. Condição periodontal de crianças e adolescentes com diabetes melito tipo 1. Arq Bras Endocrinol Metab. 2009;53:348‑54.
16. Araújo NC, Bello DMA, Crovella S, Souza PRE, Donos N, Cimões R. Mannose binding lectin genes (MBL2) polymorpshisms and the periodontal disease in diabetic patients. Rev Odonto Cienc. 2011;26:203‑8.
17. Nualart Grollmus CZN, Morales Chavéz MC, Silvestre Donat FJ. Periodontal disease associated to systemic and genetic disorders. Med Oral Patol Oral Cir Bucal. 2007;12:E211‑5.
18. Toledo OA. Odontopediatria: Fundamentos para a prática clínica. 4th ed. Rio de Janeiro: Medbook, 2012.
19. Lindhe J. Tratado de Periodontia Clínica e Implantologia Oral. 3rd ed. Rio de Janeiro: Editora Guanabara Koogan S.A., 2005.
20. Ellis JS, Seymour RA, Steele JG, Robertson P, Butler TJ, Thomason JM. Prevalence of gingival overgrowth induced by calcium channel blockers: A community‑based study. J Periodontol. 1999;70:63‑70.
21. Prisant LM, Herman W. Calcium channel blocker induced gingival overgrowth. J Clin Hypertens. 2002;4:310‑1.
22. Nowzary H, Rich SK. The impact of systemic disease‑associated gingival enlargement on pediatric patients. Compend Contin Educ Dent. 2008;29;22‑30.
23. Cianciola LJ, Park BH, Bruck E, Mosovich L, Genco RJ. Prevalence of periodontal disease in insulin‑dependent in diabetes mellitus. J Am Dent Assoc. 1982;104:653‑ 60.
24. American Academy of Periodontology. Parameters of care. J Periodontal. 2000;71(5 Suppl):i‑ii, 847‑83.
25. Ainamo J, Bay I. Problems and proposals for recording gingivitis and plaque. Int Dent J. 1975;25:229‑35.
26. López NJ, Da Silva I, Ipinza J, Gutiérrez J. Periodontal therapy reduces the rate of preterm lowbirth weight in woman with pregnancy associated gingivitis. J Periodontol. 2005;76(11 Suppl):2144‑53.
27. Soares D, Andrade C, Pinto AR, Seabra M, Macho V. Doenças da gengiva e periodonto em crianças e adolescentes. Acta Pediatr Port. 2009;40:23‑9.
28. Ministério da Saúde Brasil. Projeto SB Brasil 2003. Condições de saúde bucal da população brasileira 2002‑2003. Reultados Principais. Brasília: Coordenação Nacional de Saúde Bucal, 2004.
29. Ismail AF, McGrath CP, Yiu CK. Oral health of children with type I diabetes mellitus: A systematic seview. Diabetes Res Clin Pract. 2015;108:369‑81.
30. Van Dyke TE, Lester MA, Shapira L. The role of the host response in periodontal disease progression: implication for future treatment strategies. J Periodontol. 1993;64(8Suppl):792‑806.
31. Salvi GE, Collins JG, Yalda B, Arnold RR, Lang NP, Offenbacher S. Monocytic TNFαsecretion patterns in IDDM patients with periodontal diseases. J Clin Periodontol. 1997;24:8‑16.
32. Engebretson SP, Hey‑Hadavi J, Ehrhardt FJ et al. Gingival crevicular fluid levels of interleukin‑1β and glycemic control in patients with chronic periodontitis and type 2 diabetes. J Periodontol. 2004;75:1203‑8.
Ana Carolina de Souza Leitão
Correio eletrónico: carolinalfalcao@hotmail.com
Responsabilidades eticas
Protecao de pessoas e animais. Os autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito a privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência está na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Historial do artigo:
Recebido a 14 de Setembro de 2017
Aceite a 3 de Março de 2018
On-line a 4 de Abril de 2018
