
Revista Portuguesa de Estomatologia, Medicina Dentária e Cirurgia Maxilofacial
SPEMD - Rev Port Estomatol Med Dent Cir Maxilofac | 2018 | 59 (1) | 30-35
Investigação Original
Avaliação retrospectiva das alterações orais em crianças com leucemia linfoblástica aguda
Retrospective evaluation of oral changes in children with acute lymphoblastic leukemia
a Universidade Federal do Rio Grande do Norte, Natal, RN, Brasil
Salomão I M L Queiroz - salomaoisrael10@gmail.com
Article Info
Rev Port Estomatol Med Dent Cir Maxilofac
Volume - 59
Issue - 1
Investigação Original
Pages - 30-35
Go to Volume
Article History
Received on 21/02/2018
Accepted on 21/05/2018
Available Online on 28/06/2018
Keywords
Investigação original
Avaliação retrospectiva das alterações orais em crianças com leucemia linfoblástica aguda
Retrospective evaluation of oral changes in children with acute lymphoblastic leucemia
Emmily T F Pinto, Salomão I M L Queiroz*, Patrícia G P Goncalves, Bruno C V Gurgel
Universidade Federal do Rio Grande do Norte, Natal, RN, Brasil
http://doi.org/10.24873/j.rpemd.2018.06.224
Resumo
Objetivo: Avaliar as alterações estomatológicasde paciente com leucemia linfoblásticaaguda (LLA) em quimioterapia, bem como as abordagens terapêuticas utilizadas.
Métodos: Foi realizada uma avaliação retrospectiva por meio da coletade dados nos prontuários de crianças que estiveram em tratamento oncológico nos últimos 18 anos em um serviço de atendimento a pacientes oncológicos na cidade de Natal (LIGA). Foram avaliadas as variáveis sexo, idade, raça, manifestação oral antes e durante o tratamento quimioterápico, doenças sistêmicassimultâneas a leucemia e suas possíveis associações. Ressalta-se que um mesmo paciente pode apresentar mais uma manifestação oral.
Resultados: A amostra foi constituída por 71 prontuários de pacientes. A mucosite oral foi a alteração mais frequente (72,1%), seguida pela hiperemia (32,8%), petéquias (23%), candidíase (13,1%), fungo (4,9%), sangramento gengival (4,9%), hiperplasia, xerostomiae herpes (ambos com 3,3%), queilite, ulceração e despapilação do dorso da língua (ambos com 1,6%). A mucosite esteve mais presente no sexo feminino, sendo essa associação estatisticamente significativa (p=0,020).
Conclusão: É evidente a alta ocorrência de lesões orais durante o tratamento quimioterápico em crianças com LLA. Algumas dessas lesões podem ser evitadas ou minimizadas pela atuaçãodo Cirurgião-Dentista, na tentativa de diminuir a morbilidade relacionada a essas complicações bucais, aumentando o conforto e a qualidade de vida dos pacientes durante a terapia.
Palavras-chave: Câncer, Crianças, Leucemia, Mucosa
Abstract
Objective: To evaluate the stomatologicchanges in a patient with acute lymphoblastic leukemia (ALL) under chemotherapy, as well as the therapeutic approaches used.
Methods: A retrospective evaluation was carried out by collecting data on oncological cancer treatment in the town of Natal (LIGA). The evaluated variables were sex, age, race, oral manifestations before and during the chemotherapeutic treatment, simultaneous systemic diseases and possible associations. It should be emphasized that a single patient may present more than one oral manifestation.
Results: Seventy-one patients were evaluated. Oral mucositis was the most frequent alteration (72.1%), followed by hyperemia (32.8%), petechiae (23%), candidiasis (13.1%), fungus (4.9%), gingival bleeding (4.9%), hyperplasia (3.3%), xerostomia(3.3%), herpes (3.3%), cheilitis(1.6%), ulceration (1.6%) and depolarization of the back of the tongue (1.6%). Mucositis was more present in women, with a statistically significant association (p = 0.020).
Conclusion: There is a high incidence of lesions during chemotherapy in children with ALL. This incidence can be minimized by the dentist, in an attempt to reduce morbidity and oral complications, thus increasing the patient’s comfort and quality of life during therapy.
Keywords: Cancer, Children, Leukemia, Mucosa
Introdução
O câncer é a maior causa de morte por doenças em crianças e adolescentes, 13% a 24% nos países desenvolvidos.1 A neoplasia maligna mais prevalente nesta faixa etária é a leucemia, 25% a 50% de todos os tipos de câncer que acometem crianças e adolescentes.2
As leucemias ocorrem devido à proliferação desorganizada dos blastos. Com o acúmulo de blastos na medula óssea, as outras células sanguíneas são suprimidas e à medida que a doença progride e excesso de blastos pode ganhar a corrente sanguínea e infiltrar outros tecidos. 1, 2 A leucemia é subdividida em grupos. A primeira divisão ocorre nas formas aguda e crônica(evolução da doença), e a segunda divisão ocorre de acordo com a linhagem celular afetada, sendo denominadas leucemias mielóides e linfoides. 1, 3 A leucemia linfoblásticaaguda (LLA) é o tipo mais comum na infância. 2, 4
Os pacientes com LLA em tratamento quimioterápico apresentam manifestações bucais em 30‑95% dos casos. 5‑11
Esses pacientes também podem apresentar infiltração leucêmica gengival, processos inflamatórios gengivais acentuados, sangramentos gengivais espontâneos e sangramento submucoso bucal, devido à trombocitopenia. 5, 7
Durante o tratamento antineoplásico, as lesões orais (mucosite, xerostomia e infecções virais ou fúngicas) podem surgir como reações adversas, sendo as manifestações orais são mais comuns na fase de indução. 8‑12
A quimioterapia deveria destruir as células malignas, mas devido ao seu mecanismo de açãoinespecífico, acaba agindo também nos tecidos normais, principalmente naqueles que possuem rápida divisão celular (mucosa bucal). 10, 12
Sabe‑se, que fatorescomo tipo de droga, dose e frequência do tratamento, tipo de malignidade, idade e hábitos de higiene oral do paciente, afetamdiretamente a severidade dessas lesões. 9, 11
Essas complicações orais podem ser graves e interferir na terapêutica médica, ocasionando complicações sistêmicasque podem afetara qualidade de vida dos pacientes. 4, 6, 11 O cirurgião‑dentista (CD) é indispensável nesse contexto com o diagnóstico e ao longo do tratamento, promovendo o controledos focos de infecção e aliviando o desconforto.6
Partindo da hipótese que altas frequências de leões orais em pacientes com LLA submetidos ao tratamento quimioterápicoperdem em qualidade de vida, sendo o CD indispensável na melhora desse quadro o objetivodeste estudo é avaliar as alterações estomatológicasmais frequentes, bem como as abordagens terapêuticas mais utilizadas.
Métodos
Trata‑se de um estudo transversal, tendo como unidade de observação e análise a criança com LLA. Foram utilizados os dados presentes em prontuários da Casa Durval Paiva e Policlínica (1998‑2016). Este projetofoi submetido ao Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte.
Foram incluídos pacientes pediátricos do sexo masculino ou feminino, com idades entre 1‑16 anos, diagnosticados com LLA que foram submetidos ao tratamento antineoplásico quimioterápico.
Foram registradasinformações como identificação e os dados demográficos dos pacientes (gênero, idade, naturalidade), informações relativas à história clínica e evolução (diagnóstico da doença, data do início e do término do tratamento oncológico) e tratamento (medicação usada no tratamento), manifestações orais presentes e o protocolo de tratamento.
A análise dos dados foi realizada no SPSS (versão 22.0), sendo os dados avaliados descritivamente e em busca de possíveis associações significativas entre as características clínicas dos pacientes e as lesões orais. Para verificar as associações significativas foram utilizadosos testes do Qui‑quadrado de Pearsone o Exatode Fisher. Para todos os testes, considerando um nível de significância de 5% (P < 0,05).
Resultados
Um total 1459 pacientes pediátricos com câncer foram identificados, destes 203 com LLA. Com a avaliação das informações presentes nos prontuários, 132 prontuários de pacientes com LLA foram excluídos por informações negligenciadas. Sendo a amostra final composta por 71 pacientes com idade média de 8,93 (±4,79) anos, em sua maioria do sexo masculino 41 (57,7%) e da raça branca (59,2%). Com relação ao tratamento, todos os pacientes fizeram quimioterapia. A frequência da idade, raça, local de origem e sexo estão apresentados na Tabela 1.
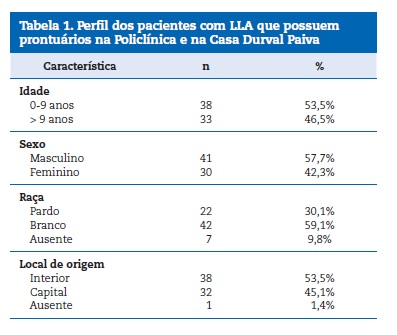
As doenças sistêmicassimultâneas a leucemia estavam presentes em 22,5% da amostra, dentre elaspneumonia (11,8%), asma (17,6%), alergia (35%), hepatite (5,9%), Síndrome de Down (11,8), alergia e gastrite (5,9%), hepatoesplenomegalia (5,9%) e gastrite (5,9%).
Em relação ao protocolo da Quimioterapia utilizado, não há um padrão de preenchimento, o que inviabiliza a análise dessa informação. Sendo assim, tal dado somente foi observado em 12 prontuários, sendo estes utilizado o protocolo para o tratamento da leucemia aguda proposto pela Sociedade Brasileira de Oncologia Pediátrica12.
A presença de manifestações orais decorrentes da leucemia, antes do estabelecimento da terapia antineoplásica, só foi observada em 3 (4,2%) pacientes da amostra, sendo que estas foram: Lesão Branca e infiltrado leucêmico.
No decorrer do tratamento antineoplásico, a presença de manifestações orais ocorreu em 85,9% da amostra. Sabendo que estas podem existir de forma associada, fez‑se necessário, primeiro, analisar suas frequências de forma isolada, as quais estão apresentadas na Tabela 2.
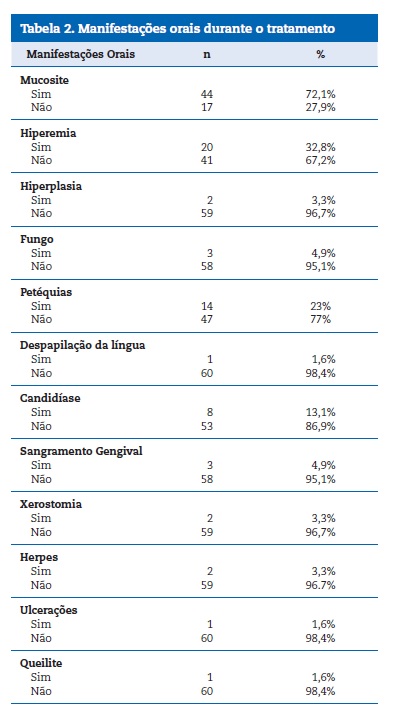
Isoladamente, a mucosite oral foi a lesão oral mais frequente (72,1%), seguida de hiperemia (32,8%), petéquias(23%), candidíase (13,1%), fungo (4,9%), sangramento gengival (4,9%), hiperplasia, xerostomia e herpes (ambos com 3,3%), queilite, ulceração e despapilaçãodo dorso da língua (ambos com 1,6%).
Ao associar as patologias orais com o sexo, temos que o sexo masculino foi mais afetado, sendo a hiperemia (75%), petéquias (71,4%) e candidíase (75%). Diferentemente da herpeslabial, que só ocorreu no sexo feminino. A hiperemia (82,4%), petéquias (83,3%) e a candidíase (15,8%) foram mais frequenteem pacientes da raça branca.
Sabendo que os pacientes podem ser acometidos por lesões associadas, pode‑se observar nesse estudo algumas associações: mucosite e hiperemia gengival (9,8%); mucosite e hiperemia (9,8%), mucosite, hiperemia e hiperplasia gengival (1,6%); fungo (3,3%); Petéquiase despapilação do dorso da língua (1,6%); mucosite, hiperemia e petéquias (6,6%); hiperemia e petéquias(1,6%); Mucosite e candidíase (8,2%); hiperemia gengival e lesão fúngica (1,6%); sangramento gengival (3,3%); petéquias(3,3%); mucosite e aftas (1,6%); mucosite, aftas, petéquiase sangramento gengival (1,6%); mucosite, candidíase e queilite (1,6%); mucosite, afta e petéquias(4,9%); xerostomia, hiperemia, ulcerações e petéquias (1,6%); mucosite e herpes (3,3%); mucosite, candidíase e aftas (1,6%); aftas (1,6%); mucosite, candidíase, hiperplasia gengival e petéquias (1,6%).
Na busca de associação entre a mucosite e as características clinicas, pode‑se perceber que essa manifestação oral esteve mais presente no sexo feminino (88%), sendo essa associação estatisticamente significativa (Tabela 3). Na Tabela 4, segue a associação com as variáveis: sexo, doença sistêmica, manifestação oral antes da quimioterapia e raça.
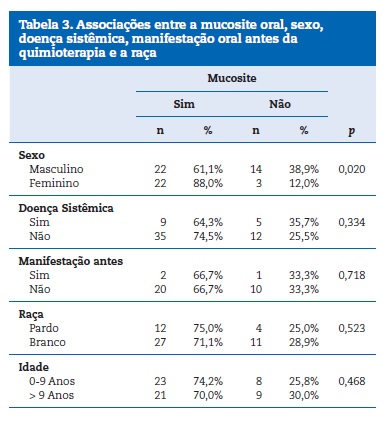
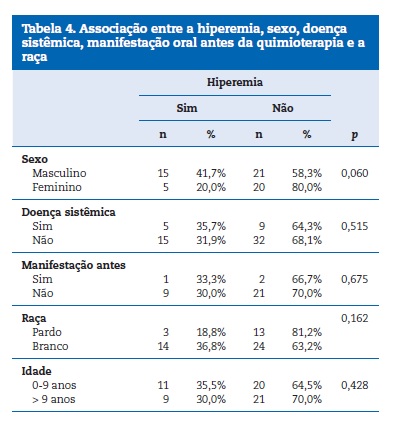
Em relação ao protocolo de tratamento utilizado para as lesões orais, a laserterapia(Laser de baixa potência: dose de 1J e fluência de 35J/cm² com tempo de aplicação de 20 segundos por ponto e com intervalos de 24h até a remissão completa das lesões) foi a mais prevalente, sendo utilizada em 93% dos casos, sendo as demais terapias feitas com clorexidina (15,5%) e algum tipo de medicação (11,3%).
Em se tratando da frequência da severidade dos graus da mucosite tem‑se que: para o Grau 0, houve 3,3%; para o Grau I, 30%, Grau II, 26.7%, Grau III, 33,3% e para o Grau IV, 6,7%.
Quando se associa o grau da mucosite com o sexo, verificou‑se que dos 16 pacientes do sexo masculino que apresentaram essa manifestação, 37,5% tiveram mucosite mais severa, sendo 25% para o grau III e 12,5% para o grau IV. Os demais apresentaram mucosite com um grau de severidade menor, sendo 31,2% para o grau II, 25% para o grau I e 6,2% para o grau 0. Dos 14 pacientes que eram do sexo feminino, nenhum apresentou mucosite grau IV nem grau 0, porém, 42,9% manifestaram a mucosite em seu grau III;21,4% teve grau II e 35,7% grau I. Entretanto, nenhum desses dados apresentou significância estatística (p>0,05).
Quando se associa a severidade da mucosite com raça, tem‑se que dos pacientes brancos, 10% tiveram mucosite grau IV, 25% grau III, 35% grau II, 30% grau I e nenhum teve grau 0. Dos pacientes pardos, nenhum paciente teve mucosite grau IV, embora 55,6% manifestaram o grau III, apenas 11,1% graus 0 e II, e 22,2% grau I.
Discussão
O transplante de células‑tronco hematopoiéticas(TCTH) é a melhor opção terapêutica para os pacientes com leucemias.
Antes do TCTH, o paciente é submetido a um regime de condicionamento (quimioterapia) que tem como objetivoa depleção das células medulares malignas, permitir o enxerto e a colonização de células‑tronco hematopoiéticas(CTH) transplantadas.
Além disso, as CTH transplantadas sofreriam rejeição em um paciente minimamente imunocompetente, portanto o condicionamento também tem como objectivo suprimir o sistema imunológico e assim evitar a rejeição das células transplantadas. 2, 12
Uma das consequências da imunossupressãoé a neutropenia, quando a contagem de neutrófilos é inferior a 1500 células/μl. A neutropenia máxima acontece 6 a 14 dias após as primeiras doses do tratamento. Esta redução significativa dos neutrófilos torna o paciente susceptível a infecções bacterianas e fúngicas. 1, 12
A presença de manifestações orais durante essa fase é muito elevada, 8‑18 mostrando a necessidade e relevância mais estudos como esse.
As alterações da cavidade oral decorrentes da quimioterapia levam, na maioria das vezes, a um agravamento do quadro geral desses pacientes, havendo a possibilidade de interrupção do tratamento (tal interrupção diminui o controle da patologia podendo levar o paciente ao óbito) e consequentemente, aumento do tempo de internação hospitalar e dos custos, além de ser considerada a causa mais comum de dor oral nesses pacientes, que atingindo níveis significativos comprometem a nutrição, pois o desconforto provocado pode levar o paciente a aumentar a ingestão de alimentos pastosos ricos em sacarose 9‑14.
Destaca‑se dentre essas alterações oraisas mucosites (72,1%, no presente trabalho). 1‑14
A mucosite possui etiologia multifatorial, e sua prevalência é elevada em pacientes que se submetem a quimioterapia. 1,14 O metotrexato(MTX) é uma das drogas mais utilizadas em crianças com leucemias, é um antagonista do ácido fólico, inibe a reprodução celular e apresenta selectividade parcial para células tumorais e toxicidade contra células normais de rápida proliferação, como as células do trato gastrintestinal e da mucosa oral, assim a fase inicial da mucosite oral ocorre geralmente imediatamente após a administração do MTX. 2, 12
As hipóteses diagnósticas do CD diante do sangramento e do aumento gengival podem levá‑loa suspeitar que sejam decorrentes de periodontite, pois o acúmulo crônicode biofilmeassociado a pobre higiene bucal pode levar a este quadro clínico, mas o paciente pode apresentar os mesmos sinais de sangramento e crescimento gengival com uma excelente higiene bucal. 4, 6, 10 ‑13
A mucosite se caracteriza por úlceras dolorosas que podem acometer todos os tecidos moles da boca e trato gastrointestinal, constituindo‑se como uma resposta inflamatória da mucosa bucal às altas doses de quimioterapia e/ou radioterapia. 8‑11
Por provocar uma condição debilitante resulta em uma queda da qualidade de vida do paciente. 9‑17
A ruptura da mucosa durante a mucosite, não apenas resulta em desconforto significante como também destrói a integridade da barreira imunológica, podendo causar sepse. 12, 18
A mucosite, como nessa pesquisa, é mais presente no sexo feminino. 2, 13, 17 As mulheres parecem ser mais suscetíveisa mucosite do que os homens, possivelmente por questões hormonais, mas não há nada comprovado. Dessa forma, é possível que gênerodesempenhe um importante papel como um fatorde risco independente e como preditivo para a mucosite oral.17
Com relação à idade, os pacientes que estavam na faixa etária de 0‑9 anos tiveram uma prevalência maior de mucosite (74,2%), fato concordante com a literatura.8‑11
Isso se pode se justificar pela alta atividademitóticadas células dos tecidos bucais de crianças de até 12 anos, tornando esse epitélio mais sensível a toxicidade da quimioterapia, alterando a proliferação celular, com consequente atrofia e perda da barreira mecânica da mucosa. 12, 13
Em busca de melhorar entendimento da mucosite a OMS passou a avaliar o paciente de acordo com a aparência da mucosa, os sintomas e a manutenção da função, variando de Grau 0 (quando não há evidência de lesão) até Grau 4 (com úlceras confluentes e a nutrição é parenteral). 8‑ 11, 17
Para este estudo, as lesões menos severas foram as mais frequentes, provavelmente pelo protocolo clinico de prevenção usado no serviço, com preparo de boca antes do início do tratamento, com raras exceções. 4, 6
A terapia com laser de baixa intensidade tem mostrado redução dos danos da mucosite nesses pacientes, pois o laser aumenta a divisão celular e a produção de colágeno. Nos tecidos gengivais, a aplicação de laser de baixa intensidade tem estimulado a síntese de DNA de fibroblastossem alterações degenerativas, transformando os fibroblastosem miofibroblastos que podem promover o reparo tecidual, além da modulação dos nocireceptorespela modificação da condução nervosa com a liberação de endorfinase encefalinas. 13, 15
A hiperemia foi a segunda manifestação oral mais frequente desse estudo. 8, 9 A hiperemia consiste em um aumento do volume sanguíneo em um determinado local, que pode ocorrer devido à leucopenia após a quimioterapia intensiva.17
Já a xerostomiaem terceiro é um efeito colateral associado a algumas drogas da quimioterapia que alteram as funções das glândulas salivares, que pode cessar logo após o término do tratamento. 8, 15
A frequência do acometimento por petéquiasdeste estudo foi condizente com a literatura. 9, 10 Sabe‑se que as petéquiaspodem se desenvolver devido à trombocitopenia, e isso se justifica tanto pelo tratamento antineoplásico, que afetaa proliferação das células epiteliais, o que resulta em atrofia do epitélio tornando‑o suscetívela traumas, quanto pela própria trombocitopenia. 14
A candidíase é uma das principais infecções oportunistas observadas, causada pela Candidaalbicans, nesse estudo teve uma frequência relativamente baixa, que pode ser explicada, pela qualidade o acompanhamento odontológico. 4, 6, 10
As infecções por vírus também podem causar sérias complicações nos pacientes em tratamento para leucemia. As que geralmente ocorrem são as lesões herpéticas pelo herpes simples e herpes zoster, sendo o herpes labial a principal infecção viral nos pacientes em quimioterapia 8, 10. Também podem apresentar sinais sistêmicosde viremia, incluindo mal‑estar e anorexia. 8, 9
A clorexidina 0,12% também foi utilizada, mas não preveniu a instalação da mucosite oral, porém, devido a sua açãoantimicrobiana, ele pode diminuir a gravidade das lesões, favorecendo o quadro clínico e o estado nutricional dos pacientes. 15
Cabe ressaltar que nesse estudo o número de prontuários incompletos, representando uma limitação desta pesquisa. Isso parece ser uma prática comum nessa modalidade de pesquisa.16
Conclusão
Com base nos resultados obtidos nesse estudo, fica evidente a alta ocorrência de lesões orais durante o tratamento antineoplásico.
As mais prevalentes nesta amostra foram: mucosite e hiperemia. Associação entre a mucosite e o sexo foi observada, sendo o feminino mais afetado.
As alterações orais podem ser evitadas ou minimizadas pelo CD, pois esses desempenham um papel fundamental no manejo das crianças com LLA, diminuindo as morbidadesrelacionadas às complicações bucais, aumentando o conforto e a qualidade de vida dos pacientes.
Referências
1. Kellie SJ, Howard SC. – Global child health priorities: what role for paediatriconcologists? EurJ Cancer. 2008;44:2388‑96.
2. Cezar CA, Dantas FJ, Jorge KR, et al. Tendenciade mortalidade por leucemia infantil num periodode 25 anos. J Pediatr. 2010;86:405‑10.
3. Braga PE, LatorreMRDO, Curado MP. Cancer na infancia: analise comparativa da incidencia, mortalidade e sobrevida em Goiania(Brasil) e outros paises. Cad. Saúde Publica. 2002;18:33‑44.
4. Santos VI, AnbinderAL, Cavalcante ASR. – Leucemia no Paciente Pediatrico: AtuacaoOdontologica. CiencOdontol Bras, 2003;6:49‑57.
5. Silva Santos PS, Fontes A, de Andrade F, de Sousa SC. Gingival leukemic inliltrationas the lirstmanifestation of acute myeloid leukemia. OtolaryngolHead Neck Surg. 2010;143:465‐6.
6. JavedF, UtrejaA, Bello Correa FO, Al‐Askar M, HudiebM, QayyumF et al. Oral health status in children with acute lymphoblastic leukemia. CritRev OncolHematol. 2012;83:303‐9.
7. Angst PD, Dutra DA, Moreira CH, Kantorski KZ. Gingival inllammationand platelet count in patients with leukemia: preliminary results. Braz Oral Res. 2011;25:544‑9.
8. Lopes IA, Nogueira DN, Lopes IA. Manifestações Orais Decorrentes da Quimioterapia em Crianças de um Centro de Tratamento Oncologico. Pesq Bras Odontoped Clin Interg. 2012;12:113‑9.
9. Hespanhol FL, Tinoco BEM, Teixeira GC, et al. Manifestações bucais em pacientes submetidos a quimioterapia. Ciencia & Saúde Coletiva. 2010;15:1085‑94.
10. Nascimento PBL, Santos LCO, Carvalho CN, et al. Avaliação das Manifestações Orais em Crianças e Adolescentes Internos em um Hospital Submetidos a Terapia Antineoplásica. Pesq Bras Odontoped Clin Integr. 2013;13:279‑85.
11. Morais EF, Lira JA, Macedo RA, et al. Oral manifestations resulting from chemotherapy in children with acute lymphoblastic leukemia. Braz J Otorhinolaryngol. 2014;80:78‑85.
12. Fonseca SM, Machado RCL, Paiva DRS, et al. Manual de quimioterapia antineoplásica. Rio de Janeiro: Reichmann; 2000. ISBN:9788587148322
13. Antunes HS, de Azevedo AM, da Silva Bouzas LF, et al. Lo‐power laser in the prevention of induced oral mucositis in bone marrow transplantation patients: a randomized trial. Blood. 2007;109:2250‑5.
14. Brennan MT, von Bultzingslowen I, SchubertMM, Keefe D. Alimentary mucositis: putting the guidelines into practice. Support Care Cancer. 2006;14:573‑9.
15. Brito CA, Araujo DS, Granja JG, et al. Efeito da clorexidina e do laser de baixa potencia na prevenção e no tratamento da mucosite oral. Rev Odontol UNESP. 2012;41:236‑41.
16. Silva FG, Tavares Neto J. Avaliação dos prontuários médicos de hospitais de ensino do Brasil. R Bras Educ Med. 2007;2:113-26.
17. Vokurka, S et al. Higher incidence of chemotherapy induced oral mucositis in females: a supplement of multivariate analysis to a randomized multicentre study. Suport Care Cancer. 2006;14:974‑6.
18. Clerehugh V, Tugnait A. Diagnosis and management of periodontal diseases in children and adolescents. Periodontology. 2000 2001;26:146‐68.
Salomão Israel Monteiro Lourenço Queiroz
Correio eletrónico: salomaoisrael10@gmail.com
Responsabilidades éticas
Proteção de pessoas e animais. Os autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos da comissão de investigação clínica e ética relevante e de acordo com os do Código de Ética da Associação Médica Mundial (Declaração de Helsínquia).
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência está na posse deste documento.
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Historial do artigo:
Recebido a 21 de Fevereiro de 2018
Aceite a 21 de Maio de 2018
On-line a 28 de Junho de 2018
